- Metalle sind zum Beispiel Eisen, Kupfer, Zink, Zinn, Aluminium, Gold, Silber.
- gemeinsame Eigenschaften: stromleitend; wärmeleitend; glänzt wenn neu; fest (Ausnahme: Quecksilber) bei 20 Grad Celsius; Einwirkung von Luft und Feuchtigkeit führt zum verschwinden des Glanzes (Oxidation); einzelne Metalle haben besondere Eigenschaften: Eisen kann von einem Magneten angezogen werden, Kupfer ist rotbraun; Quecksilber ist bei 20 Grad Celsius flüssig
Die Verwendung der Metalle wird durch ihre Eigenschaften betsimmt:
Metall |
Farbe |
Eigenschaften |
Verwendung |
| Aluminium | silberweiß | geringe Dichte, guter , beständig an trockener Luft | Kabel, Flugzeugbau, Fahrzeugbau, Gebrauchsgegenstände, Leichtbau |
| Eisen | silbergrau | große Festigkeit, magnetisch, rostet | Maschinen, Bauwesen, Geräte, Fahrzeuge, Schiffe |
| Gold | gelb glänzend | sehr beständig, guter elektrischer Leiter | Schmuckgegenstände, Gerätebau |
| Kupfer | rotbraun | dehnbar, sehr guter elektrischer und Wärmeleiter | Kabel für Elektrotechnik, Rohre für Wärmetechnik |
| Magnesium | silberweiß bis braun | geringe Dichte, leicht brennbar, wasserempfindlich | sehrleichte Bauteile, Unterwasser- fackeln |
| Silber | silberweiß | luft- und wasserbeständig, bester elektrischer Leiter | Schmuck, elektrische Kontakte, Fotografie |
| Zink | bläulich weiß bis grau | beständig an der Luft | Überzug auf Eisen (Verzinken), Batterien |
Metalle sind aus vielen Atomen aufgebaut. Die Atome werden durch starke Kräfte zusammen gehalten (Atomverband). Reine Stoffe, die aus einem Atomart aufgebaut sind, heißen Elementsubstanzen. Die Metalle sind aus einer Atomart aufgebaut und daher Elementsubstanzen. Als chemisches Element wird eine Atomart gezeichnet.
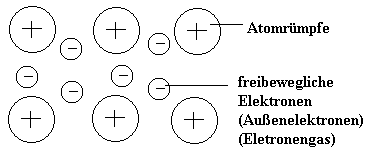
Bau der Metalle aus Atomrümpfen und frei beweglichen Außenelektronen

Zwischen den Atomrümpfen und den freibeweglichen Außenelektronen (Elektronengas) wirken Anziehungskräfte. Diese Art chemische Bindung heißt Metallbindung.
Erklärung der Verformbarkeit von Metallen
Die Atomrümpfe können Gegeneinander verschoben werden ohne die Anziehungskräfte zwischen Atomrümpfen und freibeweglichen Außenelektronen aufzugeben.
Kupfer verfärbte sich beim Erhitzen an der Oberfläche grün.
Eisen wird in Anwesenheit von feuchter Luft mit Rost überzogen.
Die Veränderung der Metalloberfläche erfolgte, weil der Luftsauerstoff mit dem Metall reagiert.
Ausgangsstoffe: Eisenwolle, Sauerstoff
Reaktionsprodukte: Eisenoxid
Wortgleichung: Eisen + Sauerstoff -> Eisenoxid
Gesetz von der Erhaltung der Masse
Bei jeder chemischen Reaktion ist die Masse der Ausgangsstoffe gleich der Masse der Reaktionsprodukte.